Актиноиды
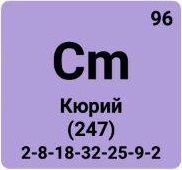
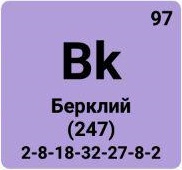
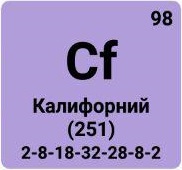
Актиноиды, актиниды, семейство из 14 химических элементов с атомными номерами Z 90-103, расположенных в 7 периоде системы Менделеева за актинием Ас и относящихся, как и актиний, к III группе системы. К Актиноидам принадлежат: торий Th (Z = 90), протактиний Ра (91), уран U (92), нептуний Np (93), плутоний Pu (94), америций Am (95), кюрий Cm(96), берклий Bk (97), калифорний Cf (98), эйнштейний Es (99), фермий Fm (100), менделевий Md (101), нобелий No (102) и лоуренсий Lr (103). Все Актиноиды радиоактивны, то есть не имеют стабильных изотопов. Th, Pa и U принадлежат к естественно-радиоактивным элементам, встречающимся в природе, и открытым ранее других Актиноидов. Остальные Актиноиды, часто называемые трансурановыми элементами, получены в 1940-63 искусственным путем при помощи ядерных реакций. Из них только Np и Pu обнаружены в ничтожно малых количествах в некоторых радиоактивных рудах, более "тяжелые" Актиноиды (т. е. Актиноиды с большими атомными номерами) в природе не найдены. Огромная заслуга в изучении Актиноидов принадлежит американскому химику Г. Т. Сиборгу, который выдвинул гипотезу о существовании группы Актиноидов (1942) и под руководством или при участии которого было впервые синтезировано девять Актиноидов. Выделение Актиноидов в специальное семейство связано со схожестью химических свойств этих элементов между собой и с актинием, что объясняется сходным строением наружных электронных оболочек их атомов (см. ниже).
Название Актиноиды (от актиний и греч. eidos - вид) означает - подобные актинию. Оно дано Актиноидам по аналогии с лантаноидами - семейством из 14 элементов, также относящихся к III группе системы Менделеева и следующих в шестом периоде за лантаном. Свойства элементов обоих семейств во многом сходны друг с другом.
Близость химических свойств Актиноидов между собой и их сходство с лантаноидами связаны с особенностями строения электронных оболочек атомов этих семейств. Как известно, атом состоит из ядра и электронных оболочек, число которых равно номеру периода элемента в таблице Менделеева (у Актиноидов электронных оболочек 7). Отличие Актиноидов (и соответственно лантаноидов) от других элементов состоит в том, что при переходе от первого Актиноида - Th (Z = 90) ко второму - Ра (Z = 91) и т. д. вплоть до последнего Актиноида - Lr (Z = 103), каждый новый электрон, появляющийся в атомах параллельно с увеличением атомного номера (Z), попадает не на внешние оболочки (6-ю и 7-ю от ядра), как это бывает обычно, а заполняет более близкую к ядру 5-ю оболочку. У лантаноидов (число оболочек 6) также заполняется электронами более близкая к ядру 4-я оболочка (а не наружные - 5-я и 6-я). Таким образом, у элементов обоих семейств происходит заполнение 3-й снаружи электронной оболочки, а строение 2 наружных оболочек оказывается сходным. Число электронов на этих наружных оболочках у Актиноидов и лантаноидов, как правило, не отличается более чем на 1, причем почти во всех случаях представители каждого из семейств, равноудаленные соответственно от лантана и актиния, содержат на 2 наружных оболочках строго одинаковое число электронов. (Здесь изложен лишь принцип заполнения электронных оболочек у атомов обоих семейств; во многих случаях, особенно у Актиноидов, порядок заполнения сложнее. Электронные конфигурации атомов Актиноиды даны в таблице.
То обстоятельство, что при переходе от Th к Lr число электронов на 2 внешних оболочках, как правило, не изменяется, а положительный заряд ядра постепенно возрастает, вызывает более сильное притяжение внешних электронов к ядру и приводит к так называемому актиноидному сжатию: у нейтральных атомов и ионов Актиноидов одинаковой валентности при увеличении атомного номера радиусы не увеличиваются, как это обычно бывает, а даже несколько уменьшаются (например, радиус U3+ равен 1,03 Å, Np3+ - 1.01 Å, Pu3+ - 1,00 Å, Am3+- 0,99 Å и т. д.).
Химические свойства элемента зависят в основном от числа электронов на наружных слоях и размера атомных и ионных радиусов, поэтому не удивительно, что во-первых, свойства Актиноидов близки между собой, и, во-вторых, химическое поведение Актиноидов и лантаноидов обладает большим сходством. Это сходство особенно заметно тогда, когда элементы находятся в одинаковом валентном состоянии. Так, 3-валентные Актиноиды образуют те же нерастворимые соединения (гидрооксиды, фториды, карбонаты, оксалаты и др.), что и 3-валентные лантаноиды; трифториды, трихлориды и другие аналогичные соединения 3-валентных Актиноидов образуют изоструктурные ряды [другими словами, соединения, входящие в такие ряды, например в ряд MeCl3, где Me - атом Актиноидов, обладают сходными кристаллическими решетками, параметры которых постепенно уменьшаются по мере роста атомного номера (Z) атома Актиноидов]. Такие же изоструктурные ряды образуют оксиды (IV), тетрафториды, гексафториды и другие соединения Актиноидов. По склонности к гидролизу соединения 5-валентных Актиноидов, например пентахлориды, очень близки между собой. В растворах 6-валентные Актиноиды существуют в виде МеО22+-ионов и т. д. Приведенные примеры далеко не исчерпывают всех случаев сходства Актиноидов, но и на них можно убедиться в его наличии.
Однако, кроме общих черт, между Актиноидами и лантаноидами имеется и существенная разница. Так, Актиноиды часто образуют соединения в состояниях окисления, значительно более высоких, чем +3, что не характерно для лантаноидов. В своих соединениях Актиноиды проявляют следующие валентности: Th (3, 4), Pa (3, 4, 5), U (3, 4, 5, 6), Np (3, 4, 5, 6, 7), Pu (3,4,5, 6, 7), Am (3, 4, 5, 6), Cm (3, 4), Bk (3,4), Cf (2, 3), Es (3), Fm (3), Md (2, 3), No (2, 3). Таким образом, валентность З характерна для Актиноидов только после Am. Первые члены семейства Актиноидов (Th, Pa и U) в своих соединениях чаще бывают соответственно 4-, 5- и 6-валентными. Актиноиды в большей степени, чем лантаноиды, склонны к комплексообразованию. Указанные особенности Актиноидов объясняются тем, что "вновь пришедшие" на 5-ю от ядра оболочку электроны (так называемые 5f-электроны или электроны 5f-подуровня) по энергии связи с ядром очень близки к электронам 6-й оболочки (так называемым 6d-электронам или электронам 6d-подуровня); эти 6d-электроны и могут проявлять себя как дополнительные валентные (см. табл.). У лантаноидов же "вновь пришедшие" 4f-электроны всегда связаны с ядром значительно прочнее, чем 5d-электроны.
|
Электронные конфигурации атомов актиноидов |
||||||||
|
Элемент |
Число электронов на некоторых подуровнях |
|||||||
|
5-й оболочки |
6-й оболочки |
7-й оболочки |
||||||
|
s |
p |
d |
f |
s |
p |
d |
s |
|
|
Th |
2 |
6 |
10 |
0 |
2 |
6 |
2 |
2 |
|
Ра |
2 |
6 |
10 |
2 |
2 |
6 |
1 |
2 |
|
U |
2 |
6 |
10 |
3 |
2 |
6 |
1 |
2 |
|
Np |
2 |
6 |
10 |
4 |
2 |
6 |
1 |
2 |
|
Pu |
2 |
6 |
10 |
6 |
2 |
6 |
0 |
2 |
|
Am |
2 |
6 |
10 |
7 |
2 |
6 |
0 |
2 |
|
Cm |
2 |
6 |
10 |
7 |
2 |
6 |
1 |
2 |
|
Bk |
2 |
6 |
10 |
8 |
2 |
6 |
1 |
2 |
|
Cf |
2 |
6 |
10 |
9 |
2 |
6 |
1 |
2 |
|
Es |
2 |
6 |
10 |
11 |
2 |
6 |
0 |
2 |
|
Fm |
2 |
6 |
10 |
12 |
2 |
6 |
0 |
2 |
|
Md |
2 |
6 |
10 |
13 |
2 |
6 |
0 |
2 |
|
No |
2 |
6 |
10 |
14 |
2 |
6 |
0 |
2 |
|
Lr |
2 |
6 |
10 |
14 |
2 |
6 |
1 |
2 |
в основном, от ионного радиуса элементов, причем можно подобрать такие условия, что быстрее всего колонку покинут ионы с наименьшими радиусами. Так как радиусы ионов от Th к Lr постепенно уменьшаются, то выход ионов Актиноидов будет происходить в последовательности, обратной их атомным номерам Z. Порядок в выходе Актиноидов выполняется столь строго, что дает возможность по наличию радиоактивных атомов в той или иной порции раствора, прошедшего через колонку, сделать вывод, какие именно элементы присутствуют в смеси, и точно определить их порядковые номера. Метод обладает высокой избирательностью, требует небольших затрат времени и пригоден даже тогда, когда в наличии имеется лишь несколько атомов элемента. Он был использован, в частности, при открытии Bk, Cf, Es, Fm и Md.
Из всех Актиноидов к настоящему времени практическое применение находят главным образом Th, U и Рu. Изотопы 233U, 235U и 239Рu служат как ядерное горючее в атомных реакторах и играют роль взрывчатого вещества в атомных бомбах. Некоторые изотопы Актиноидов (238Pu, 242Cm и другие), испускающие α-частицы высокой энергии, могут служить для создания источников тока со сроком службы до 10 лет и более, необходимых, например, для питания навигационной радиоаппаратуры спутников. В таких источниках тока тепловая энергия, выделяющаяся при радиоактивном распаде, при помощи специальных устройств преобразуется в электрический ток. Изучение свойств Актиноидов имеет большое теоретическое значение, так как позволяет расширить знания о свойствах атомных ядер, химическом поведении элементов
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Портал Gosstanart.info не осуществляет коммерческой деятельности, не сотрудничает с рекламодателями, производителями товаров и компаниями предоставляющими услуги. Просьба, не обращаться с коммерческими предложениями! Вся информация, представленная на портале, результат независимых исследований и является свободно распространяемой информацией.