Переходные металлы 6 период
Переходные металлы (элементы) располагаются в побочных подгруппах Периодической системы Д.И. Менделеева. Их подразделяют на d-элементы и f-элементы. f-элементы – это лантаноиды и актиноиды.
В общем виде электронное строение переходных элементов можно представить следующим образом: (n – 1) dxnsy. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на (n - 1) d-орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Название "переходные" связано с тем, что в периодах переходные элементы вклиниваются между s- и р-элементами.
В отличие от s- и p-элементов, у которых заполняются внешние оболочки (соответственно ns- и np-оболочки), у переходных металлов заполняются внутренние (n — 1) d-оболочки (d-элементы) или (n — 2) f-оболочки (f-элементы).
Все переходные элементы имеют следующие общие свойства:
- Небольшие значения электроотрицательности.
- Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
- Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные.
- Для всех переходных элементов характерно образование комплексных соединений.
При образовании соединений атомы металлов могут использовать не только валентные s- и p-электроны, но и d-электроны. Поэтому для d-элементов гораздо более характерна переменная валентность, чем для элементов главных подгрупп. Благодаря этому свойству переходные металлы часто образуют комплексные соединения.
Все переходные элементы металлы. Поэтому в своих соединениях они проявляют положительные степени окисления. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
Есть три примечательных элемента из семейства переходных металлов. Эти элементы — железо, кобальт и никель, и они являются единственными элементами которые способны создавать магнитное поле.
Переходные элементы, кроме Fe и Ti, мало распространены в земной коре.
Значение переходных металлов для организма и жизнедеятельности.
Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкеновна платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов.
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит. При исследовании сплавов прослеживается уникальное значение железа для человека. Сплавы даже разделяют на черные и цветные по содержанию в них железа.
Переходные металлы 6 период:
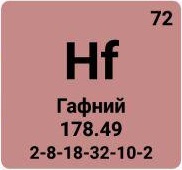
- Гафний
- Тантал
- Вольфрам
- Рений
- Осмий
- Иридий
- Платина
- Золото
- Ртуть
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Портал Gosstanart.info не осуществляет коммерческой деятельности, не сотрудничает с рекламодателями, производителями товаров и компаниями предоставляющими услуги. Просьба, не обращаться с коммерческими предложениями! Вся информация, представленная на портале, результат независимых исследований и является свободно распространяемой информацией.