Лантаноиды
Лантаноиды (от лантан и греч. eidos - образ, вид), лантаниды, семейство из 14 химических элементов с атомными номерами от 58 до 71, расположенных в шестом периоде системы Менделеева вслед за лантаном (табл. у. Лантаноиды и сходные с ними элементы скандий, иттрий и лантан образуют группу редкоземельных элементе в (в литературе ее обозначают сокращенно РЗЭ). Такое название объясняется тем, что все эти элементы встречаются редко и дают тугоплавкие, нерастворимые в воде оксиды, по старинной терминологии, - "земли". Редкоземельные элементы входят в побочную подгруппу III группы периодической системы.
По химическим свойствам Лантаноиды весьма сходны между собой, что объясняется строением электронных оболочек их атомов: по мере увеличения заряда ядра структура двух внешних электронных оболочек не меняется, так как происходит заполнение электронами 3-й снаружи оболочки - глубоколежащего 4f-ypoвня. Максимально возможное число электронов на f-уровне равно 14, что определяет число элементов семейства Лантаноиды. Лантаноиды подразделяются на 2 подгруппы: цериевую, включающую церий Ce, празеодим Pг, неодим Nd, прометий Pm, самарий Sm, европий Eu, и иттриевую, включающую гадолиний Gd, тербий Tb, диспрозий Dy, гольмий Но, эрбий Er, тулий Tm, иттербий Yb, лютеций Lu. Это деление обусловлено периодичностью изменения некоторых свойств внутри семейства Лантаноидов; названия подгрупп возникли исторически.
Историческая справка. В 1788 году в шведском селении Иттербю был найден минерал иттербит (позднее переименованный в гадолинит). В нем Ю. Гадолин обнаружил в 1794 году новую "землю", названную иттриевой. В 1803 году И. Я. Берцелиус и В. Гизингер (1766-1852) и независимо от них М. Клапрот (1743-1817) в "тяжелом камне из Бастноса" открыли цериевую "землю" (названную по малой планете Церере). Первоначально обе эти "земли" считались оксидами неизвестных прежде металлов - иттрия и церия. В 1843 году швед, химик К. Г. Мосандер (1797- 1858) разложил иттриевую "землю" на собственно иттриевую, эрбиевую и тер- биевую (все три названия - от Иттербю). Ж. Маринъяк (1878) выделил из эрбиевой "земли" еще иттербиевую, а шведский химик П. Т. Клеве (1879) - гольмиевую (от Holmia - латинское название Стокгольма) и тулиевую (от Thule - древнегреческого названия стран, лежащих на Крайнем Севере). В 1886 году П. Э. Лекок де Буабодран разделил гольмиевую "землю" на собственно гольмиевую и диспрозиевую (от греч. dysprositos - труднодоступный). В 1907 году французский химик Ж. Урбен (1872-1938) нашел в иттербиевой "земле" лютециевую (от Lutetia - латинское название Парижа). То же самое повторилось и с цериевой "землей". В 1839-41 годах Мосандер разложил ее на лантановую (от греч. lanthano - скрываюсь), дидимовую (от греч. didymos - близнец) и собственно цериевую "земли". Лекок де Буабодран, исследуя дидимовую "землю", полученную из уральского минерала самарскита [назв. так в 1847 году Генрихом Розе (1795-1864) в честь начальника штаба Корпуса горных инженеров В. Е. Самарского-Быховца (1803-70), от которого Розе получил значительное количество этого минерала], выделил из нее в 1879 году самариевую "землю", а в 1886 - гадолиниевую (по имени Гадолина); она оказалась тождественной с "землей", которую Мариньяк открыл в 1880 в самарските. В 1885 австрийский химик К. Ауэр фон Вельсбах (1858-1929) разделил дидимовую "землю" на празеодимовую (от греч. prasios - светло-зеленый) и неодимовую (от греч. neos - новый). В 1901 году французский химик Э. Демарсе (1852-1904) разделил самариевую "землю" на собственно самариевую и европиевую.
Так, к первым годам 20 века были открыты все Лантаноиды, за исключением радиоактивного элемента с атомным номером 61, который в природе не встречается. Его получили только в 1947 американские физики Дж. Марийский, Л. Гленденин и Ч. Кориелл из осколков деления урана в ядерном реакторе и назвали прометием (от имени Прометея).
Хотя открытие Лантаноидов было завершено в начале 20 века, многие из них не были ни выделены в достаточно чистом состоянии, ни подробно изучены. Современные эффективные методы разделения позволяют получать и производить в чистом виде и соединения Лантаноидов, и сами металлы.
Распространение в природе. Суммарное содержание лантана и Лантаноидов в земной коре составляет 1,78·10-2% по массе, причем кларки у Лантаноиды с четными атомными номерами больше, чем у соседних нечетных. Лантаноиды - характерные элементы земной коры ; в породах мантии, в каменных метеоритах их мало. При магматических процессах Лантаноиды накапливаются в гранитоидах и особенно в щелочных породах. Известно 33 минерала церия и 9 лантана, остальные Лантаноиды входят как изоморфные примеси в кристаллическую решетку других минералов, преимущественно редкоземельных. Во многих минералах Лантаноиды изоморфно замещают Са, U, Th и другие. В биосфере Лантаноиды малоподвижны, с чем связано накопление их в россыпях. Содержание Лантаноидов в природных водах и организмах ничтожно. Их водная и биогенная миграция изучена плохо. Известны гидротермальные месторождения фосфатов, фторкарбонатов и фторидов Лантаноидов, однако наибольшее промышленное значение имеют комплексные месторождения, связанные со щелочными магматическими породами (например, нефелиновые сиениты Кольского полуострова) и карбонатитами, а также месторождения осадочных фосфоритов, кора выветривания щелочных пород, прибрежно-морские и аллювиальные россыпи ксенотима и монацита.
Физические свойства. Лантаноиды - металлы серебристо-белого цвета (некоторые слегка желтоваты, например Рг и Nd). Кристаллическая структура большинства Лантаноидов - гексагональная плотноупакованная. Исключение составляют γ-Ce и α-Yb (кубическая гранецентрированная), Sm (ромбоэдрическая), Eu - кубическая объемноцентрированная. То обстоятельство, что при переходе от Се к Lu число электронов на двух внешних оболочках, как правило, не меняется, а положительный заряд ядра постепенно возрастает, вызывает более сильное притяжение электронов к ядру и приводит к так называемому лантаноидному сжатию; у нейтральных атомов Лантаноидов и ионов одинаковой валентности при увеличении атомного номера радиусы несколько уменьшаются. Температуры плавления у элементов подгруппы церия значительно ниже, чем у элементов подгруппы иттрия.
Лантаноиды высокой чистоты пластичны и легко поддаются деформации (ковке, прокатке). Механические свойства сильно зависят от содержания примесей, особенно кислорода, серы, азота и углерода. Значения предела прочности и модуля упругости металлов иттриевой подгруппы (за исключением Yb) выше, чем для цериевой. Все Лантаноиды, за исключением La и Lu, обладают при температуpax выше комнатной сильным парамагнетизмом, причиной которого является наличие у этих элементов нескомпенсированных в 4f-подоболочках спиновых и орбитальных магнитных моментов. В области низких температур большинство Лантаноидов цериевой подгруппы (Nd, Pr, Sm) находится в антиферромагнитном состоянии, а Лантаноиды иттриевой подгруппы (Tb, Dy, Ho, Er и Tm) при очень низких температуpax - в ферримагнитном состоянии, а при более высоких температуpax переходят в так называемых геликоидальное антиферромагнитное состояние. Gd при всех температуpax ниже 293 К (т. е. до точки Кюри) находится в ферромагнитном состоянии.
Металлы Tb, Dy, Ho, Er и Tm обладают большими величинами намагниченности насыщения, огромными значениями энергии магнитной анизотропии и магнитострикции, что позволяет на основе этих металлов создавать магнитные материалы (сплавы, ферриты, халькогениды и другие) с уникальными свойствами. α-La становится сверхпроводником при 4,9 К, β-La при 5,85 К.
Атомный номер, атомная масса и некоторые другие свойства элементов семейства лантаноидов
|
Название |
Сим вол |
Ат. ном. |
Атомная масса |
Содерж. в земной коре, % масс. |
|
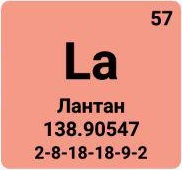
Лантан |
La |
57 |
138,9055 |
2,9·10-3 |
|
Церий |
Се |
58 |
140,12 |
7·10-3 |
|
Празеодим |
Рr |
59 |
140,9077 |
9·10-4 |
|
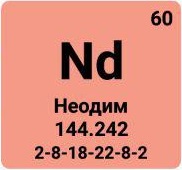
Неодим |
Nd |
60 |
144,24 |
3,7·10-3 |
|
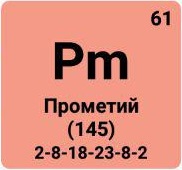
Прометий |
Рm |
61 |
[145]* |
- |
|
Самарий |
Sm |
62 |
150,4 |
8·10-4 |
|
Европий |
Eu |
63 |
151,96 |
4,3·10-4 |
|
Гадолиний |
Gd |
64 |
157,25 |
8·10-4 |
|
Тербий |
Тb |
65 |
158,9254 |
4,3·10-4 |
|
Диспрозий |
Dy |
66 |
162,50 |
5·10-4 |
|
Гольмий |
Но |
67 |
164,9304 |
1,7·10-4 |
|
Эрбий |
Er |
68 |
167,26 |
3,3·10-4 |
|
Тулий |
Тm |
69 |
168,9342 |
2,7·10-5 |
|
Иттербий |
Yb |
70 |
173,04 |
3,3·10-5 |
|
Лютеций |
Lu |
71 |
174,97 |
8·10-5 |
* Массовое число наиболее долго живущего изотопа 145Pm.
Электронная структура, валентность и некоторые другие свойства элементов семейства лантаноидов
|
Название |
Сим вол |
Электронная структура |
Ва лент ность |
Ионн. радиус |
Энерг. иониз., эв |
Магн. моменты 3-вал. ионов в магнетонах Бора* |
|
Лантан |
La |
[Xe] 5d16s2 |
3 |
1,061 |
36,2 |
0 |
|
Церий |
Се |
[Xe] 4f25d06s2 |
3, 4 |
1,034 |
37,2 |
2,51 |
|
Празеодим |
Рr |
[Xe] 4f35d06s2 |
3, 4 |
1,013 |
37,5 |
3,6 |
|
Неодим |
Nd |
[Xe] 4f45d06s2 |
3 |
0,995 |
37,8 |
3,61 |
|
Прометий |
Рm |
[Xe] 4f55d06s2 |
3 |
0,979 |
38,2 |
- |
|
Самарий |
Sm |
[Xe] 4f65d06s2 |
2, 3 |
0,964 |
38,2 |
1,54 |
|
Европий |
Eu |
[Xe] 4f75d06s2 |
2, 3 |
0,950 |
38,8 |
3,62 |
|
Гадолиний |
Gd |
[Xe] 4f75d16s2 |
3 |
0,938 |
38,6 |
7,8-7,84 |
|
Тербий |
Тb |
[Xe] 4f95d06s2 |
3, 4 |
0,923 |
39,4 |
9,76 |
|
Диспрозий |
Dy |
[Xe] 4f105d06s2 |
3 (4) |
0,908 |
39,5 |
10,59 |
|
Гольмий |
Но |
[Xe] 4f115d06s2 |
3 |
0,894 |
40,0 |
10,50 |
|
Эрбий |
Er |
[Xe] 4f125d06s2 |
3 |
0,881 |
40,2 |
9,53 |
|
Тулий |
Тm |
[Xe] 4f135d06s2 |
3 (2) |
0,869 |
40,3 |
7,2 |
|
Иттербий |
Yb |
[Xe] 4f145d06s2 |
2, 3 |
0,858 |
40,8 |
4,6 |
|
Лютеций |
Lu |
[Xe] 4f145d16s2 |
3 |
0,848 |
41,0 |
0 |
* По измерениям парамагнитной восприимчивости.
Физические свойства лантана, лантаноидов, а также иттрия и скандия
|
Ме талл |
Плотность (рентг.), г/см3 |
Тпл |
Ткип |
Уд. об. электрич. сопротивл. (при 25°С), ом·см·106 |
Сечение захвата тепловых нейт ронов, σ |
Работа выхода электр., эв |
Модуль упругости, кгс/мм2 |
|
α (La) |
6,17 |
920 |
3470 |
56,8 |
8,9 |
3,33 |
3915 |
|
γ-Ce |
6,77 |
795 |
3470 |
75,3 |
0,70 |
2,84 |
3058 |
|
α-Рr |
6,78 |
935 |
3130 |
68,0 |
11,2 |
2,7 |
3592 |
|
α-Nd |
7,01 |
1024 |
3030 |
64,3 |
44 |
3,3 |
3860 |
|
α-Sm |
7,54 |
1072 |
1900 |
88 |
6500 |
3,2 |
3480 |
|
Eu |
5,26 |
826 |
1440 |
81,3 |
4500 |
2,54 |
- |
|
α-Gd |
7,89 |
1312 |
3000 |
140,5 |
44000 |
3,07 |
5730 |
|
α-Тb |
8,27 |
1356 |
2800 |
- |
44 |
3,09 |
5864 |
|
Dy |
8,53 |
1407 |
2600 |
56 |
1100 |
3,09 |
6433 |
|
Но |
8,80 |
1461 |
2600 |
87 |
64 |
3,09 |
6850 |
|
Er |
9,05 |
1497 |
2900 |
107 |
166 |
3,12 |
7474 |
|
Tm |
9,33 |
1545 |
1730 |
79 |
118 |
3,12 |
- |
|
α-Yb |
6,98 |
824 |
1430 |
27 |
36 |
2,59 |
1815 |
|
Lu |
9,84 |
1652 |
3330 |
79 |
108 |
3,14 |
- |
|
α-Sc |
2,99 |
1539 |
2730 |
- |
13 |
3,23 |
- |
|
Y |
4,48 |
1509 |
2930 |
69±3 |
1,38 |
3,07 |
6700 |
Примечание. Структура, плотность и ряд других свойств приведены для модификации, устойчивой при комнатной температуре. 1 кгс/мм2 10 Mн/м2.
Химические свойства. Лантаноиды отличаются высокой химические активностью. При нагревании они реагируют с водородом, углеродом, азотом, фосфором, углеводородами, оксидами углерода II и IV; разлагают воду, растворяются в соляной, серной и азотной кислотах; выше 180-200°С Лантаноиды быстро окисляются на воздухе. Для всех Лантаноидов характерна валентность 3. Некоторые Лантаноиды проявляют, кроме того, валентность 4 или 2.
Оксиды Лантаноидов и лантана тугоплавки. Гидрооксид R(ОН)3 имеют основной характер и нерастворимы в щелочах. Хлориды, сульфаты и нитраты трехвалентных Лантаноидов растворимы в воде и кристаллизуются большей частью в виде кристаллогидратов различного состава. Фториды, оксалаты, фосфаты, карбонаты и ферроцианиды малорастворимы в воде и разбавленных минеральных кислотах. Трехзарядные катионы Се, Gd, Tb, Yb, Lu бесцветны, Pm, Eu, Er имеют розовый цвет, Sm, Dy, Ho - желтый, Рг и Tm - зеленый, Nd - фиолетово-красный.
Большинство простых солей Лантаноидов склонно к образованию двойных солей с солями щелочных металлов, аммония, магния. Лантаноиды дают комплексные соединения с многими органическими веществами. Среди них важное значение имеют комплексы, образуемые с лимонной кислотой и рядом аминополиуксусных кислот: нитрилотриуксусной, этилендиаминтетрауксусной кислотой и других "комплексонами". Эти соединения используются в процессах разделения Лантаноидов.
Получение. Основными источниками получения РЗЭ цериевой группы служат минералы монацит (фосфат РЗЭ и тория), бастнезит (фторкарбонат РЗЭ) и лопарит (сложный титанониобат натрия, кальция и РЗЭ); главные источники РЗЭ группы иттрия - эвксенит, фергюсонит, ксенотим (иттропаризит) и гадолинит. Для извлечения РЗЭ монацитовые и бастнезитовые концентраты разлагают концентрированной серной кислотой при нагревании до 200 °С с последующим выщелачиванием массы водой. Из сернокислых растворов первоначально выделяют торий, а затем осаждают РЗЭ в виде оксалатов, двойных сульфатов или других соединений. Для разложения монацитовых концентратов используют также обработку растворами щелочи, растворяя образующуюся при этом смесь гидроокисей в соляной или азотной кислоте. Бастнезитовые концентраты обжигают при 400-800 °С с целью частичного или полного разложения минерала, сопровождающегося выделением СО2.
Продукт обжига обрабатывают азотной кислотой. Из раствора осаждают РЗЭ в виде фторидов или двойных сульфатов или извлекают экстракцией трибутилфосфатом. Сложное сырье типа лопарита хлорируют в присутствии угля при 700-800° С. Летучие хлориды титана, ниобия и тантала удаляются с газами. В печи остается сплав хлоридов РЗЭ. Хлориды растворяют в воде, выделяя затем оксалаты РЗЭ. Эвксенит также рекомендуется перерабатывать методом хлорирования.
Методы разделения Лантаноидов основаны на небольших различиях в свойствах их соединений. Ранее для этой цели использовали дробную кристаллизацию солей (например, двойных нитратов и других), дробное осаждение (гидрооксидов, сульфатов, оксалатов и других). В настоящее время основными являются экстракционные методы разделения, в которых используется различие коэффициентов распределения между водным раствором и органических растворителем. Эти методы в сочетании с ионообменной хроматографией обеспечивают получение всех Лантаноидов высокой степени чистоты. В схемах разделения, кроме того, используют способность некоторых Лантаноидов к окислению до четырехвалентного состояния (применяется для отделения Ce) или восстановлению до двухвалентного (Sm, Eu, Yb).
Для получения металлов применяют металлотермию или электролиз. Металлотермический метод основан на восстановлении безводных хлоридов или фторидов чистым кальцием. Процесс ведут в стальных бомбах, футерованных оксидом кальция, или в тиглях из тантала в атмосфере чистого аргона. Этим способом могут быть получены все Лантаноиды, кроме Sm, Eu и Yb. Последние можно восстановить из их оксидов лантаном с последующей дистилляцией образующихся металлов.
Все Лантаноиды можно получить электролизом их соединений в солевых расплавах. Металлы подгруппы Ce выделяют электролизом безводных хлоридов в расплавах КCl + СаCl2 или КCl + NaCl. В случае металлов иттриевой подгруппы (более тугоплавких) электролиз ведут с жидким катодом из кадмия или цинка, которые затем отгоняют в вакууме. Электролитические металлы менее чисты, чем металлотермические.
Области применения. Лантаноиды (в виде металлов, сплавов и химические соединений) применяют в различных отраслях техники. Присадки Лантаноидов (главным образом Ce или его сплава с La) улучшают структуру, механические свойства, коррозионную устойчивость и жаропрочность стали, чугуна, магниевых, алюминиевых и других сплавов. Добавки оксидов различных Лантаноидов сообщают стеклу особые физические свойства и окраску. Оксид церия II СеО2используют для полировки оптического стекла. Оксиды Лантаноидов применяют для окраски фарфора, глазурей и эмалей. Церий или сплав Лантаноидов цериевой группы ("мишметалл") входит в состав нераспыляющихся поглотителей газов (геттеров) в электровакуумных приборах. Бориды некоторых Лантаноидов идут на изготовление катодов мощных электронных приборов. В СВЧ электронике и вычислительной технике используют редкоземельные ферриты-гранаты и ортоферриты, а в радиоэлектронике и микроэлектронике - редкоземельные сплавы (типа SmCo5), из которых изготовляют постоянные магниты рекордной энергии. Лантаноиды входят в состав кристаллов для лазеров (добавки соединений Лантаноидов в кристаллы CaF2 и других солей); в атомной технике используют Лантаноиды с высоким сечением захвата тепловых нейтронов (Gd, Sm, Eu) для защиты от излучений и управления работой реакторов. В химической и легкой промышленности соединения Лантаноидов служат для изготовления лаков и красок, светящихся составов (люминофоров), катализаторов, фотореагентов. Важное применение нашли некоторые радиоактивные изотопы Лантаноидов. Так, изотоп прометия (147Pm) применяют для изготовления микробатарей; изотоп тулия (170Tm) - в портативных рентгеновских установках медицинского назначения. В сельском хозяйстве соединения Лантаноидов применяют в качестве инсектицидов и микроудобрений. Этим перечнем далеко не исчерпываются области использования Лантаноидов.
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Портал Gosstanart.info не осуществляет коммерческой деятельности, не сотрудничает с рекламодателями, производителями товаров и компаниями предоставляющими услуги. Просьба, не обращаться с коммерческими предложениями! Вся информация, представленная на портале, результат независимых исследований и является свободно распространяемой информацией.